Kategorie Vitalstoffe
Niacin – Histamin, Flush und Co.
Dieses außerordentlich spannende Thema verdient mehr Diskussion, obwohl ein vollständiges Verständnis vermutlich so schnell nicht vorhanden sein wird. Ich bin über einen Blogeintrag von Dr. Marek Doyle – denn ich vorher gar nicht kannte – wieder dafür sensibilisiert worden und einiges ist mir ins Auge gesprungen, über das ich hier schreiben möchte. Auch vor dem …
Gehalte von Vitalstoffen in NEMs, Deklarationen, Vorgaben – viel hilft viel? Beispiel Silizium und Magnesium
Wie ist das eigentlich mit den Gehalten an wirksamen Inhaltsstoffen, Zutaten, Aussagen über Anwendungsgebiete und so weiter…? Häufigst gestellte Fragen wie 1. Ist da wirklich 95% OPC enthalten? 2. In dem Produkt ist 60% Magnesium enthalten. Ist das nicht das beste? 3. Im Produkt ist 70% Silizium enthalten. Das ist doch sicher das, was am …
Antivirale Wirkung – wie funktioniert das? Kieselsäure als Beispiel
Oft werde ich gefragt: wie wirkt denn ein Stoff antiviral? Eine Bestandsaufnahme am Beispiel von Silizium und einer überaus interessanten Publikation zum Thema Silizium und Phosphat (2,3). Es ist nie NUR die EINE Substanz wirksam gegen Viren. Das ist schon deswegen so, weil Viren sehr unterschiedlich sein können was 1. Größe 2. Beweglichkeit 3. RNA(größe) …
Weiterlesen „Antivirale Wirkung – wie funktioniert das? Kieselsäure als Beispiel“ »
Nierensteine und Vitamin C und D, Blasensteine, Gallensteine und Gicht – Ursachen und Prävention
Als Festkörperchemiker ist mir dieses Thema besonders wichtig und vielleicht wirft eine spezielle Sichtweise auch ein neues Licht auf das altbekannte Thema. Was sind die Ursachen von Steinen? Was sind Risikofaktoren und was kann ich präventiv tun? Wann genau bilden sich Nierensteine, wann Gallensteine, wann Blasensteine? Und wann bekommt man einen ‚akuten Gichtanfall‘? Wie spielt …
MCT-Öl, Kokosöl und Silizium – Einige wissenswerte Details
Die ursprünglich englische Bezeichnung meint Medium-Chained-Triglycerides, also mittelkettige voll gesättigte Fettsäuren, die mit Glycerin verestert/funktionalisiert sind. Dazu gehören: Capronsäure (C6), Caprylsäure (C8), Caprinsäure (C10) und Laurinsäure (C12). Eigentlich könnte man davon ausgehen, dass je kürzer die Fettsäure, umso besser bioverfügbar ist sie. Deshalb wird auf Seiten wie bulletproof.com MCT als ‚brain octane‘ (brain: gelangt schnell …
Weiterlesen „MCT-Öl, Kokosöl und Silizium – Einige wissenswerte Details“ »
Vitamin C – natürlich oder künstlich – synthetisch?
Prof. Dr. Linus Pauling ist der untrennbar damit verbundene Name. Weil ich viel zu oft gefragt werde: was ist das? Ist natürliches Vitamin C besser als künstliches? Ist synthetisches Vitamin C schädlich? Was muss ich noch beachten? Vitamin C ist Ascorbinsäure – nicht mehr und nicht weniger. Dabei wird leider nicht unterschieden, ob in oxidierter …
Weiterlesen „Vitamin C – natürlich oder künstlich – synthetisch?“ »
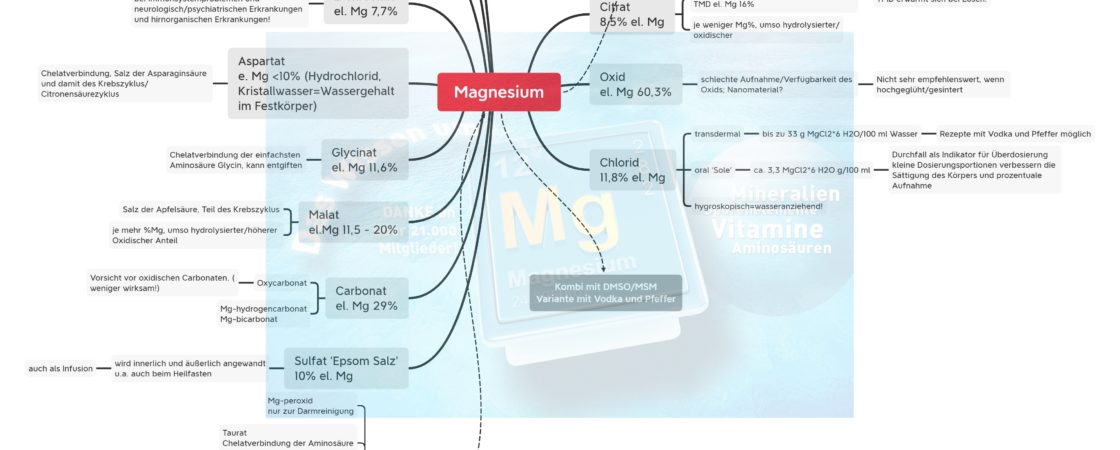
Magnesium – was wir (noch) nicht wissen
Magnesium ist unbestritten das wichtigste Mineral in der Orthomolekularen Medizin. Was aber bisher etwas zu kurz kam sind einige aus meiner Sicht sträflich vernachlässigte Punkte, die verantwortlich sind für die heute weit verbreiteten Mangelzustände. 1. Die Aufnahme ist an die Mitochondrienleistung gebunden. Ob die Ausscheidung auch von der Mitochondrienleistung abhängt, ist an den Stoffwechsel u.a. …
Vitamin B3 – das wichtigste B-Vitamin?
Dieses überaus interessante Vitamin hat vielfältige Eigenschaften, die bis heute nicht vollständig verstanden sind. Niacin verursacht einen Flush, transportiert damit Wärmeenergie und wirkt cholesterinsenkend sowie antipsychotisch und antidepressiv; Niacinamid hat ebenfalls antidepressive Eigenschaften, kann gegen Arthritis gute Dienste leisten und NADH wird bei Parkinson und ähnlichen Erkrankungen eingesetzt. Weitere Therapieoptionen sind wenig bekannt. In Büchern …
Zink und Vitamin A – wie passt das zur aktuellen Infektionslage?
Wir leben in Zeiten von Existenz- und Zukunftsangst. Es gibt viele Studien zu Mikronährstoffen, die bei dem aktuellen Coronaproblem unterstützen können. Dazu werden oft Vitamin D3, K2 und Magnesium genannt. Allerdings gibt es auch weitere sog. ‚Cofaktoren‘ von Vitamin D, die ebenso Einfluss auf das Immunsystem haben. Das sind die Vitalstoffe Zink und Vitamin A …
Weiterlesen „Zink und Vitamin A – wie passt das zur aktuellen Infektionslage?“ »