Bodenbakterien brauchen Silizium. Und sie nutzen Energiequellen wie Vitamin K2.
Diese Symbiose findet nicht nur im Boden statt, sondern auch in uns.
Wie lässt sich das nutzen und wie sind hier die Zusammenhänge genau?
Einige kennen möglicherweise Nattokinase bzw. Natto. Dieses wird durch Fermentation von Sojabohnen im sauren pH-Bereich hergestellt. Die zugehörige Bakteriengattung ist Bacillus subtilis natto.
Bacillus subtilis ist ein ‚Heubazillus‘, also eigentlich ein Bodenbakterium. Es kommt in vielen Stämmen vor und gehört auch im Dickdarm des Menschen zur obligaten Darmflora – und hat hier durchaus interessante Eigenschaften zur Symbioselenkung (1, 2).
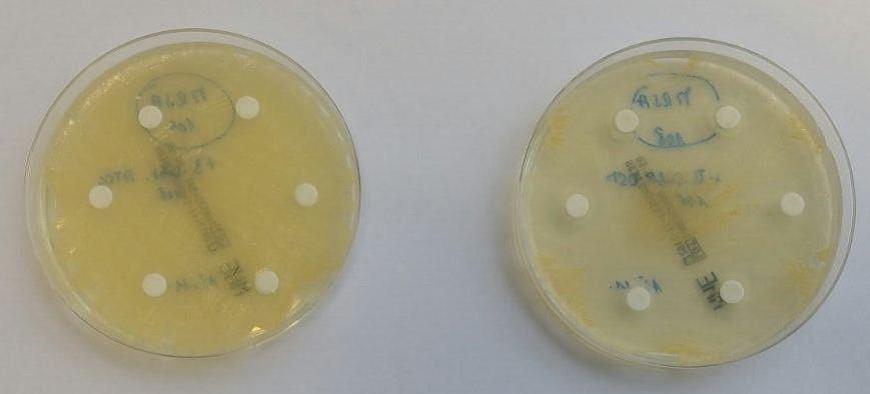
Einige Stämme dieses Bacillus subtilis können Surfactine ausbilden (3). Das sind bestimmte Lipoproteine (Fett-Eiweiß-Strukturen) – Schleimstoffe, welche die Darmschleimhaut auskleiden, deren Austrocknen verhindern, Austausch mit benachbarten Zellen und Membranen ermöglichen und die Immunabwehr damit unterstützen. Doch damit nicht genug: sie können offenbar auch andere produzierte Vitalstoffe in dieser Mucus-Schicht ‚parken‘ und zwischen ‚guten‘ (symbiose- bzw. vielfalt-fördernden) und schlechten (pathogen wirkenden) Darmbakterien unterscheiden. So konnten Untersuchungen mit pathogenen MRSA-Keimen zeigen, dass die Aktivität bestimmter Subtilis-Stämme wie DSM21097 das Wachstum MRSA-kolonialisierter Petrischalen zurückdrängt, was an einfachen ‚Hemmhöfen‘ leicht zu erkennen ist.
Gleichzeitige Untersuchungen parallel dazu mit Laktobazillen und Bifidobakterien ergaben synergetische Effekte, die also zu vermehrtem Wachstum dieser für uns guten Bakterien führten.
Dieses Surfactin wird vermutlich nicht von allen Subtilis-Stämmen genutzt/produziert und die Forschung dazu steckt noch in den Anfängen (4); jedoch lohnt sich schon jetzt ein etwas genauerer Blick auf die Zusammenhänge (3c-e).
Diese betreffen nicht nur die Eigenschaften bestimmter Stämme, Silizium zu verbrauchen (vermutliche Katalysatorfunktion bzw. Akkumulation im Bakterium wie bei Diatomeenarten), sondern auch die Eigenschaften, pH-abhängig Vitamin K2 zu produzieren.
Dazu gehört die durchaus interessante Detailinfo, dass russische Studien eine sehr hohe Bindungsaffinität von Silizium an Lipoproteine und damit auch Surfactine nachgewiesen haben (3 bzw. Literatur des Blogeintrags auf rilling-healthcare.de). Speziell für Surfactine dürfte diese noch einmal etwas besser sein, was mit den Teilchengrößen und der jeweiligen Mobilität der Teilchen zusammenhängt.
Beide (Vitamin K2, besonders Menachinon MK-7 und Silzium als kolloidale Kieselsäure) sind vermutlich Cofaktoren von Vitamin D, d.h. wirken eng mit diesem Sonnenhormon zusammen.
Einfach herstellbare Zusammenhänge sind hier etwa die Transporterfunktion für Calcium, die in der Literatur für Silizium hinreichend beschrieben wurde und für K2 auch gesichert ist (Matrix-GLA-Proteine in Abhängigkeit von der Carboxylierung).
Die erwähnte Carboxylierung ist hier der Schlüssel, da nur in carboxylierter Form Calcium transportiert werden kann.
Ob allerdings diese Carboxylate nur Calcium transportieren und nicht auch Magnesium oder auch andere Spurenelemente, muss erst noch eruiert werden.
Bei Silizium in kolloidaler Form ist es im Reich der Diatomeen so, dass Silizium unter anderem als Transporter für die meisten Spurenelemente dient. Diese logische Schlussfolgerung ergibt sich auch aus Strukturbetrachtungen an Oligokieselsäuren, die ihrerseits leicht als Chelatverbindung für andere Spurenelemente dienen können.
Aufgrund des reichhaltigen Vorkommens in der Umwelt ist das vermutlich auch für den Menschen Teil der Evolution gewesen (5, 6).
Vitamin K2 zeigt eine ähnliche chemische Struktur wie ein anderes Coenzym, was uns bestens bekannt ist: Coenzym Q10. Dieses hat eine überaus große Bandbreite in seiner Wirkung und wird von manchen als Synonym für ATP-Äquivalente angesehen. Bei Bakterien nutzen die Stämme ersatzweise Vitamin K2, das offenbar ähnlich hohen Energieinhalt hat. Uwe Gröber spricht in seinen Arbeiten von der Eigenschaft des K2, eine Art Mediator für Q10 zu sein.
So ist es nicht verwunderlich, dass aufgrund der bestehenden Studienlage ein separater RDI für Menachinon gefordert wird (5).
Dies umso mehr, als dass vermehrt auftretende Darmdysbiosen zu einem Mangel an Vitamin K2 führen und so zu einem Teufelskreis werden: weniger gute Bakterien –> weniger K2-Produktion –> schlechtere Ca-Verwertung lokal –> weniger Vitamin-D-Stoffwechsel im Darm möglich –> schlechtere Immunität –>weniger gute Bakterien. Welche Rolle hier Silizium noch spielt, kann bisher nur theoretisch betrachtet werden und empirisch anhand von Studien beobachtet werden: Wirklich wissenschaftlich verstanden sind diese Vorgänge in der Praxis nicht.
Das mag auch daran liegen, dass die Mikrobiota, also die Gesamtheit der vorhandenen Bakterienstämme in unterschiedlichen Mengen so in vitro gar nicht nachgestellt werden kann wie im wirklichen Leben. Dafür sind die Bedingungen zu einzigartig und zusätzlich individuell, wie zB. in den Forschungen von Prof. Bosch nachzulesen ist (7).
Für Silizium sind Eigenschaften wie Wasserbindung, Transporterfunktionen für Ca, Mg – auch Fe und P sowie vermutlich viele weitere – , Protein- und Lipidaffinitäten, dosisabhängig antibiotische Eigenschaften, zellpotentialdefinierende Funktionen, aber auch toxinbindende und pH-ausgleichende Aufgaben wichtige Voraussetzungen für die Erhaltung einer gesunden Darmflora.
Das mag alles trivial klingen; es ist trotz allem die Frage zu stellen, ob wir angesichts ausgelaugter Böden, mangelnder Bodenqualität und fehlender Besiedlung mit fruchtbaren Bodenbakterien sowie Huminstoffen und Huminsäuren genügend verwertbare Kieselsäure in unserer industriell verarbeiteten Nahrung haben – und ob sie tatsächlich unverändert bis in den Dickdarm gelangt und wenn ja, wie tief in die Darmschleimhäute.
Fazit
Angesichts aktueller Forderungen eines von Vitamin K1 separaten RDI für Vitamin K2 – speziell für Menachinon-MK-7 – scheint auch hier eine Betrachtung unter Einbeziehung ausreichender Mengen an kolloidaler Kieselsäure sinnvoll und wichtig zu sein um eine intakte Darmflora herzustellen und zu erhalten, um auch ein gesundes Ökosystem Darm und damit ein gesundes Ökosystem Mensch zu ermöglichen.
Welche Auswirkungen das alles auch auf weitere mit Silizium und Menachinon-verbundene Mikronährstoffe wie Vitamin D und A hat, ist ein zukünftiges sehr interessantes Forschungsfeld, das unbedingt mehr Aufmerksamkeit verdient hat.
Unabhängig davon wirft die Verarmung des Bodens an Mineralien und Humus sowie mutmaßlich damit in Verbindung stehender Bakterien die Frage von Zusammenhängen zwischen einem gestörten Ökosystem Umwelt auf, das direkt auch auf uns einwirkt. Immerhin haben wir deutlich mehr Bakterien in uns als körpereigene Zellen.
Literatur (Auswahl)
1. a) U. Gröber und K. Kisters, Vitamin K in der Prävention und Therapie, EHK 2016, 65; 184-191.
Online zugänglich unter vitaminspur.de/pdf/06_Groeber_Online-PDF.PDF?v=1
b) https://www.pharmawiki.ch/wiki/index.php?wiki=Fermentierte%20Lebensmittel
2. Skorochod, I.O., Roy, A.O. & Kurdish, I.K. Influence of Silica Nanoparticles on Antioxidant Potential of Bacillus subtilis IMV B-7023. Nanoscale Res Lett 11, 139 (2016). https://doi.org/10.1186/s11671-016-1348-2. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4788668/
3. a) Petra Uttlová, Dominik Pinkas, Olga Bechyňková, Radovan Fišer, Jaroslava Svobodová, Gabriela Seydlová,
Bacillus subtilis alters the proportion of major membrane phospholipids in response to surfactin exposure,
Biochimica et Biophysica Acta 1858 (2016) 2965–2971. https://doi.org/10.1016/j.bbamem.2016.09.006.
(http://www.sciencedirect.com/science/article/pii/S0005273616302954)
b) Pers. Mitt. aus Korrespondenz mit Magnat Vital U.G. sowie Rilling Healthcare GmbH.
c) Interview zum Thema Bacillus Subtilis DSM21097 (1)
d) Interview zum Thema Bacillus Subtilis DSM21097 (2) in Kombination mit Moringa
e) Weitere Infos über Bacillus subtilis inkl. einiger Studienlinks
4. G. Beckmann, A. Rüffer, Mikröökologie des Darms, Labor L+S AG, 5. Auflage 2019.
5. Akbulut, A.C.; Pavlic, A.; Petsophonsakul, P.; Halder, M.; Maresz, K.; Kramann, R.; Schurgers, L. Vitamin K2 Needs an RDI Separate from Vitamin K1. Nutrients 2020, 12, 1852. https://doi.org/10.3390/nu12061852.
6. Internetpräsenz von Prof. Bosch, http://www.bosch.zoologie.uni-kiel.de/
7. W.E.G. Müller (ed.) in: Progress in Molecular and Subcellular Biology, Bd. 33: Silicon Biomineralization, Springer 2003.
8. zur Stressantwort von Bac. subtilis ssp.:
https://www.frontiersin.org/articles/10.3389/fmicb.2022.914713/full
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9794813/, https://pubmed.ncbi.nlm.nih.gov/36409125/,
https://www.google.com/url?sa=t&rct=j&q=&esrc=s&source=web&cd=&cad=rja&uact=8&ved=2ahUKEwi__suy4Iv_AhXOs6QKHZgLDI0QFnoECCsQAQ&url=https%3A%2F%2Fpure.uva.nl%2Fws%2Ffiles%2F1518370%2F130888_thesis.pdf&usg=AOvVaw2gTKibPWDI_QSsOR-Ivxw8
Beitragsbild: Magnat Vital UG